Pengertian Atom
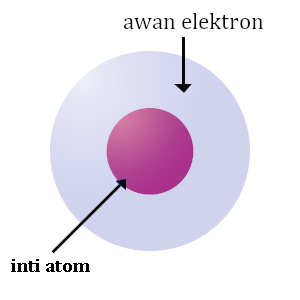
Atom adalah suatu partikel terkecil dari suatu materi yang terdiri dari inti atom dimana inti atom terdiri dari proton dan neutron kecuali pada atom hidrogen-1 karena atom hidrogen tidak memiliki neutron, inti atom tersebut dikelilingi oleh awan elektron yang bermuatan negatif.
Teori Atom
Kata atom berasal dari bahasa Yunani yaitu ”atomos” yang berarti ”tidak dapat dibagi”. Konsep dasar atom pertama kali dikemukakan oleh Democritus (orang Yunani) pada awal abad ke-4 Sebelum Masehi.
Menurut teori yang dikemukakannya, suatu benda dapat dibagi menjadi bagian-bagian yang sangat kecil yang akhirnya tidak dapat dibagi lagi yang disebut atom.Menurut Democritus atom sepenuhnya padat, tidak memiliki struktur internal, serta ada ruang kosong antar atom untuk memberikan ruang untuk pergerakannya (seperti pergerakan dalam air dan udara, atau fleksibilitas benda padat).
Selain itu, Democritus juga menjelaskan bahwa untuk menjelaskan perbedaan sifat dari material yang berbeda, atom dibedakan ke dalam bentuk, massa dan ukurannya. Berdasarkan model atom yang dibuatnya, Democritus mampu menjelaskan bahwa semua benda terdiri dari bagian yang lebih kecil disebut atom. Namun model Democritus ini kurang memiliki bukti eksperimental hingga mulai tahun 1800an muncul teori-teori baru berdasarkan hasil eksperimen. Beberapa teori yang menjelaskan tentang model-model atom adalah sebagai berikut :
Teori Model Atom John Dalton
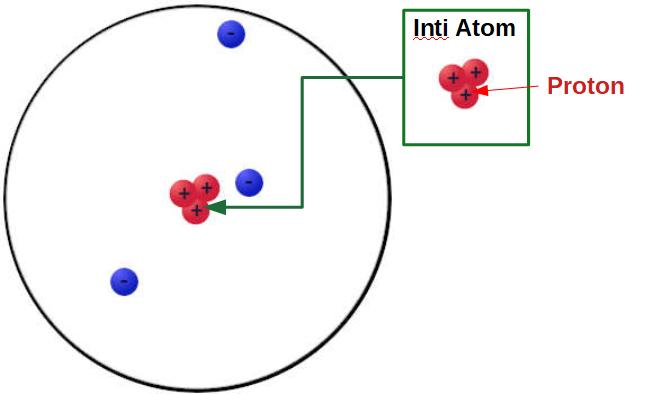
John Dalton ilmuwan asal Inggris pada 1808 mengemukakan bahwa atom merupakan suatu zat inti yang tidak bisa dibagi lagi. Berdasarkan hasil penelitiannya Ia mengemukakan bahwa:
- Suatu materi yang terdiri dari atom yang tidak bisa dibagi lagi,
- Bentuk inti atom digambarkan sebagai sebuah bola pejal,
- Unsur kimia berbeda maka jenis atomnya berbeda,
- Atom pada unsur yang sama maka massa dan sifatnya sama,
- Senyawa terbentuk dari atom-atom,
- Reaksi kimia dapat terjadi karena proses penggabungan atau pemisahan atom.
Dari hasil penelitiannya Dalton mampu menerangkan Hukum Kekekalan Massa Lavosier yang berbunyi “Massa sebelum reaksi = massa setelah reaksi” dan Hukum Perbandingan Tetap Proust yang berbunyi “Sebuah senyawa kimia terdiri dari unsur-unsur dengan perbandingan massa yang selalu sama”.
Namun beberapa teori yang dikemukakan dalton tidak sepenuhnya benar karena dikemudian J.J. Thompson mengemukakan bahwa atom memiliki muatan listrik negatif yang disebut elektron. Dikemudian hari diketahui juga bahwa atom masih dapat dibagi lagi menjadi sub-atom. Dan juga diketahui bahwa massa pada jenis atom yang sama dapat berbeda.
Teori Model Atom J.J. Thomson
Pada 1897 Joseph John Thomson melaukan percobaan melewatkan arus melalui tabung sinar katoda, dari percobaan ini diketahui bahwa berkas sinar katoda bermuatan negatif yang ada pada setiap unsur materi. Dengan percobaan ini pada tahun 1898 J.J. Thomson menyimpulkan teori model atom:
- Atom memiliki muatan negatif yang disebut elektron,
- Jumlah muatan negatif dan positif adalah sama,
- Atom digambarkan sebagai sebuah bola dengan elektron yang tersebar merata dalam bola tersebut. Jika seumpamakan sebuah atom adalah jambu biji yang telah dikupas kulitnya maka tiap biji-biji tersebut adalah elektronnya dan daging jambu biji itu sendiri adalah muatan positifnya yang tersebar merata pada seluruh bagian.
Teori dari Thomson melengkapi teori dari Dalton karena pada teori atom Thomson menjelaskan tentang sifat listrik pada atom dan membuktikan bahwa atom masih dapat dibagi lagi menjadi sub-atom.
Kekurangan dari teori atom Thompson adalah bahwa dikemudian hari diketahui muatan positif pada tidak tersebar merata pada atom, hal ini dibuktikan oleh Philipp Lenard (1903)
Teori Model Atom Rutherford
Ernest Rutherford pada 1911 melakukan percobaan menembakan sinar alpha ke lempengan emas. Dari percobaan tersebut sinar alpha ada yang dipantulkan, diteruskan, dan ada yang dibelokkan. Sinar alpha yang mengenai elektron akan diteruskan. Percobaan ini dikenal dengan Percobaan Geiger-Marsden, nama ini diambil berdasarkan nama dua muridnya yang membantu melakukan percobaan tersebut, yaitu Hans Geiger dan Ernest Marsden.
Dari percobaan ini Rutherford menyimpulkan teori bahwa:
- Volume atom memiliki bagian hampa,
- Massa atom terpusat pada inti atom,
- Muatan elektron pada atom tidak mempengaruhi hamburan sinar alpha, Karena sinar alpha diteruskan ketika mengenai elektron
- Pada inti atom (yang kemudian dikenal sebagai nukleus) banyak berpusat muatan positif (sejenis dengan partikel alpha) yang menyebabkan sinar alpha dipantulkan,
- Diketahui bahwa atom memiliki diameter 105 kali lebih besar dibanding inti atomnya.
Ia membangun model atom seperti sistem tata-surya dimana Inti atom dikelilingi oleh awan-awan elektron.
Teori ini mendukung penelitian oleh Philipp Lenard sebelumnya yang menyatakan bahwa muatan positif pada atom tidak tersebar merata seperti daging pada buah jambu biji melainkan terdapat ruang-ruang hampa.
Kelemahan teori atom Rutherford adalah Ia tidak menjelaskan susunan elektron yang mengelilingi inti atom dan tidak sesuai dengan hukum fisika klasik Maxwell yang yang menyebutkan bahwa jika partikel bermuatan(elektron) bergerak melingkar mengelilingi partikel yang bermuatan sebaliknya (inti atom yang bermuatan positif) maka muatan tersebut akan mengalami percepatan dan mengeluarkan radiasi elektromagnet yang menyebabkan energi pada muatan (elektron) tersebut secara perlahan akan menghilang dan akhirnya jatuh dan bergabung dengan muatan yang dikelilingi tersebut. Hukum fisika klasik ini memprediksi bahwa tidak mungkin atom mencapai kestabilan namun dikemudian hari diketahui bahwa atom bersifat stabil sehingga atom tidak bergabung dengan inti atom.
Teori Model Atom Niels Bohr
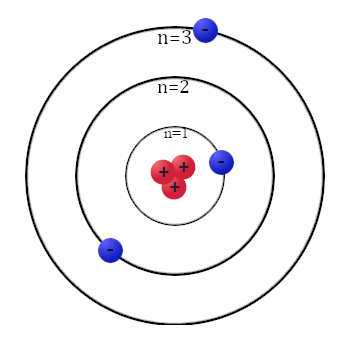
Model Atom Niels Bohr merupakan modifikasi dari model atom yang dipresenstasikan oleh Rutherford. Model atom Bohr menggambarkan bahwa atom adalah inti kecil bermuatan positif yang dikelilingi muatan negatif (elektron) yang mempunyai orbit (disebut juga kulit elektron). Pada 1913 Niels Bohr mengusulkan dalil tentang teori atom, yaitu:
- Elektron mengelilingi inti atom pada tingkat energi tertentu yang disebut kulit elektron, semakin besar lingkaran kulit semakin besar pula energi elektron pada orbit tersebut,
- Elektron dapat berpindah dari kulit elektron ke kulit elektron lain dengan menyerap atau melepaskan energi,
- Eletron yang bergerak mengelilingi inti atom tidak akan kehilangan energinya secara perlahan hingga jatuh ke inti atom karena elektron tidak memancarkan/melepaskan energi jika berada pada orbitnya yang stasioner (tetap/tidak berubah).
Teori Model atom Bohr ini sekaligus menyatakan bahwa hukum mekanika klasik tentang gerak elektron di sekitar inti atom tidak berlaku, dengan hal ini Bohr mengusulkan hukum mekanika baru yaitu mekanika kuantum.
Kelebihan dari teori model atom Bohr adalah Bohr mampu menjawab kelemahan sekaligus menyempurnakan teori atom Rutherford tentang gerak elektron yang mengelilingi inti atom dan mampu menjelaskan tingkat-tingkat energi elektron pada setiap kulit eketron.
Kelemahan pada teori atom bohr adalah Ia hanya dapat menerangkan atom atau ion yang mengandung satu elektron, model atom ini tidak sesuai dengan atom atau ion yang berelektron banyak, belum mampu menjelaskan ikatan kimia atom sehingga menjadi molekul dan orbit/kulit elekron mengelilingi inti atom bukan berbentuk lingkaran melainkan berbentuk elips
Teori Model Atom Modern (Mekanika Kuantum)
Teori model atom modern didasarkan pada teori mekanika kuantum yaitu:
- Elektron bersifat gelombang dan partikel, oleh Louis de Broglie (1923),
- Persamaan gelombang elektron dalam atom, oleh Erwin Schrodinger (1926),
- Asas ketidakpastian, oleh Werner Heisenberg (1927).
Menurut teori mekanika kuantum elektron tidak bergerak pada lintasan tertentu. Berdasarkan teori tersebut pemodelan atom menurut mekanika kuantum adalah sebagai berikut:
- Atom terdiri dari inti atom yang mengandung proton dan neutron, serta elektron-elektron mengelilingi inti atom pada orbital-orbital tertentu yang membentuk kulit atom
- Dengan memadukan azas ketidakpastian Heisenberg dan mekanika gelombang dari Broglie maka Schodinger merumuskan konsep “Orbital adalah suatu ruangan dimana peluang elektron ditemukan”,
- Kedudukan elektron pada orbital-orbitalnya dinyatakan dengan bilangan kuantum.
Demikian artikel Pengertian Atom dan Perkembangan Teori Model-model Atom menurut para ahli yang dilengkapi gambar ini dibuat, semoga bermanfaat. Artikel dikutip dari berbagai sumber yang sudah dicantumkan dibawah berikut.
Referensi
Devi, K. Poppy dkk. 2009. Kimia 1 untuk SMA/MA Kelas X. Jakarta: Pusat Perbukuan, Departemen Pendidikan Nasional.
Permana, Ivan. 2009. Memahami Kimia Kelas X SMA dan MA, Semester 1 dan 2. Jakarta: Pusat Perbukuan, Departemen Pendidikan Nasional.
“√5 Teori Atom : Dalton , Thomson , Rutherford , Bohr dan Mekanika Kuantum”. dosenpintar.co.id. 9 November 2019. 10 November 2019.
“Kelebihan dan Kelemahan Teori Atom Dalton Thomson Rutherford Bohr dan Mekanika Kuantum”. Pelajar Belajar. September 2019. 10 November 2019.
“Teori Atom JJ THOMSON”. Slideshare. 31 Januari 2016. 10 November 2019.
“Teori Atom Rutherford”. Ilmu Kimia. Agustus 2013. 10 November 2019.
“Teori Atom Bohr”. Ilmu Kimia. Januari 2013. 10 November 2019.
“Kelebihan dan Kekurangan Teori Model Atom Bohr”. EDUTAFSI.COM. 11 September 2017. 10 November 2019.
“Teori Atom Bohr (Tata Surya)”. Tentorku. 25 Agustus 2015. 10 November 2019.